Los alcanos son hidrocarburos saturados, están formados exclusivamente por carbono e hidrógeno y únicamente hay enlaces sencillos en su estructura.
Fórmula general: CnH2n+2 donde “n” represente el número de carbonos del alcano.
Esta fórmula nos permite calcular la fórmula molecular de un alcano. Por ejemplo para el alcano de 5 carbonos: C5H [(2 x 5) +2] = C5H12
Serie homóloga.- Es una conjunto de compuestos en los cuales cada uno difiere del siguiente en un grupo metileno (-CH2-), excepto en los dos primeros.
Fórmula molecular
|
Nombre
|
Fórmula semidesarrollada
|
Metano
| ||
Etano
| ||
Propano
| ||
Butano
| ||
Pentano
| ||
Hexano
| ||
Heptano
| ||
Nonano
| ||
Decano
|
La terminación sistémica de los alcanos es ANO. Un compuestos con esta terminación en el nombre no siempre es un alcano, pero la terminación indica que es un compuesto saturado y por lo tanto no tiene enlaces múltiples en su estructura.
b) Nomenclatura de alcanos






PILORISIS
Es el proceso por medio del cual los hidrocarburos de alto peso molecular se rompen a altas temperaturas en presencia de un catalizador y en ausencia del oxígeno, para evitar la combustión.

ALQUENO
Los alquenos son hidrocarburos insaturados que tienen uno o varios dobles enlaces carbono-carbono en su molécula. Se puede decir que un alqueno es un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
NOMENCLATURA
Los alquenos se nombran reemplazando la terminación -ano del correspondiente alcano por -eno. Los alquenos más simples son el eteno y el propeno, también llamados etileno y propileno a nivel industrial.





REACCIONES QUIMICAS




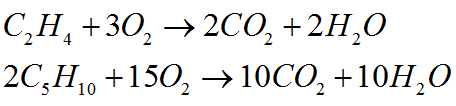
ALQUINOS
Los alquinos son hidrocarburos alifáticos con al menos un triple enlace -C≡C- entre dos átomos de carbono. Se trata de compuestos metaestables debido a la alta energía del triple enlace carbono-carbono. Su fórmula general es CnH2n-2
NOMENCLATURA
Regla 1. Los alquinos responden a la fórmula CnH2n-2 y se nombran sustituyendo el sufijo -ano del alca-no con igual número de carbonos por -ino.

Regla 2. Se elige como cadena principal la de mayor longitud que contiene el triple enlace. La numeración debe otorgar los menores localizadores al triple enlace.

Regla 3. Cuando la molécula tiene más de un triple enlace, se toma como principal la cadena que contiene el mayor número de enlaces triples y se numera desde el extremo más cercano a uno de los enlaces múltiples, terminando el nombre en -diino, triino, etc.

Regla 4. Si el hidrocarburo contiene dobles y triples enlaces, se procede del modo siguiente:
1. Se toma como cadena principal la que contiene al mayor número posible de enlaces múltiples, prescindiendo de si son dobles o triples.
2. Se numera para que los enlaces en conjunto tomen los localizadores más bajos. Si hay un doble enlace y un triple a la misma distancia de los extremos tiene preferencia el doble.
3. Si el compuesto tiene un doble enlace y un triple se termina el nombre en -eno-ino; si tiene dos dobles y un triple, -dieno-ino; con dos triples y un doble la terminación es, -eno-diino

REACCIONES QUÍMICAS



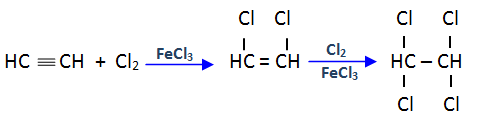



b) Nomenclatura de alcanos
1.- La base del nombre fundamental, es la cadena continua más larga de átomos de carbono.
2.- La numeración se inicia por el extremo más cercano a una ramificación. En caso de encontrar dos ramificaciones a la misma distancia, se empieza a numerar por el extremo más cercano a la ramificación de menor orden alfabético. Si se encuentran dos ramificaciones del mismo nombre a la misma distancia de cada uno de los extremos, se busca una tercera ramificación y se numera la cadena por el extremo más cercano a ella.
3.- Si se encuentran dos o más cadenas con el mismo número de átomos de carbono, se selecciona la que deje fuera los radicales alquilo más sencillos. En los isómeros se toma los lineales como más simples. El n-propil es menos complejo que el isopropil. El ter-butil es el más complejo de los radicales alquilo de 4 carbonos.
4.- Cuando en un compuestos hay dos o más ramificaciones iguales,no se repite el nombre, se le añade un prefijo numeral. Los prefijos numerales son:
Número
|
Prefijo
|
2
|
di ó bi
|
3
|
tri
|
4
|
tetra
|
5
|
penta
|
6
|
hexa
|
7
|
hepta
|
6.- Se escriben las ramificaciones en orden alfabético y el nombre del alcano que corresponda a la cadena principal, como una sola palabra junto con el último radical. Al ordenar alfabéticamente, los prefijos numerales y los prefijos n-, sec- y ter- no se toman en cuenta.
7.- Por convención, los números y las palabras se separan mediante un guión, y los números entre si, se separan por comas.
La comprensión y el uso adecuado de las reglas señaladas facilitan la escritura de nombres y fórmulas de compuestos orgánicos.
10 Ejemplos de alcanos:
- Metano (CH4)
- Gas LP o Gas Licuado de petróleo, es una mezcla de gas propano (C3H8) y butano (C4H10)
- Gas Natural que es una mezcla principalmente de Metano (CH4) con Etano (C2H6) y Propano (C3H8)
- Gasolina que es una mezcla de octanos (C8H18)
- Diesel (C14H30)
- Combustóleo (C7H16)
- Etano (C2H6)
- Propano (C3H8)
- Pentano (C5H12)
- Decano (C10H22)
Combustión
Los alcanos son buenos combustibles al contacto con la llama, se incendian en oxígeno del aire y desprenden anhidrido carbónico y H2O, además de abundante calor.

Ejemplos:
1. CH4 + 2 O2 → CO2 + 2 H2O
2. C3H8 + 5 O2 → 3 CO2 + 4 H2O
3. C4H10 + 13 O2 → 8 CO2 + 10 H2O
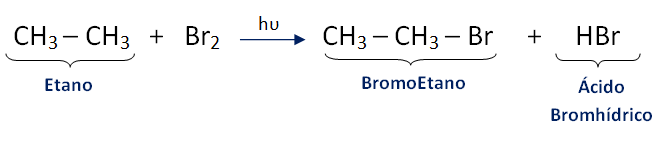
Halogenación
Los alcanos reaccionan con los halógenos, principalmente cloro y bromo; la reacción es fotoquímica, es decir necesita presencia de luz, pudiendo realizarse también en la oscuridad a altas temperaturas (de 250°C o mayor)
La halogenación es una reacción de sustitución, logrando sustituirse en la molécula del alcano, átomos de hidrógeno por átomos de halógeno.

Ejemplo 1: Bromación del etano

Nitración
Los alcanos logran nitrarse, al reaccionar con acido nítrico concentrado, sustituyendo hidrogeno por el grupo Nitro (-NO2).
Esta reacción a presion atmosferica, en fase vapor o temperaturas entre 420 a 475°C y en presencia de ácido sulfúrico.

Ejemplo:

Ciclación
Los alcanos a temperaturas entre 500 y 700°C, logran deshidrogenarse en presencia de catalizadores especiales que son Cr2O3 ó Al2O3 ; los alcanos de seis a diez atomos de carbono dan hidrocarburos aromáticos monocíclicos.
Ejemplo 1: Ciclación del hexano

Ejemplo 2: Ciclación del heptano

PILORISIS
Es el proceso por medio del cual los hidrocarburos de alto peso molecular se rompen a altas temperaturas en presencia de un catalizador y en ausencia del oxígeno, para evitar la combustión.
ALQUENO
Los alquenos son hidrocarburos insaturados que tienen uno o varios dobles enlaces carbono-carbono en su molécula. Se puede decir que un alqueno es un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
NOMENCLATURA
Los alquenos se nombran reemplazando la terminación -ano del correspondiente alcano por -eno. Los alquenos más simples son el eteno y el propeno, también llamados etileno y propileno a nivel industrial.
Regla 1.- Se elige como cadena principal la de mayor longitud que contenga el doble enlace. La numeración comienza en el extremo que otorga al doble enlace el menor localizador.
Regla 2.- El nombre de los sustituyentes precede al de la cadena principal y se acompaña de un localizador que indica su posición en la molécula. La molécula se numera de modo que el doble enlace tome el localizador más bajo.
Regla 3.- Cuando hay varios sustituyentes se ordenan alfabéticamente y se acompañan de sus respectivos localizadores
Regla 4.- Cuando el doble enlace está a la misma distancia de ambos extremos, se numera para que los sustituyentes tomen los menores localizadores.
Regla 5.- En compuestos cíclicos resulta innecesario indicar la posición del doble enlace, puesto que siempre se encuentra entre las posiciones 1 y 2.
REACCIONES QUIMICAS
Adición con hidrógeno
Los alquenos pueden hidrogenar en presencia de catalizadores, que son el platino (Pt), paladio (Pd), ó niobio (Nb) finalmente divididos, generando un alcano.
Ejemplos:

Adición con halógenos
Un alqueno puede reaccionar con un halógeno, formando un alcano dihalogenado vecinal; los átomos de halógeno se adicionan en cada carbono que contenía el doble enlace, previo rompimiento de éste.
Ejemplos:

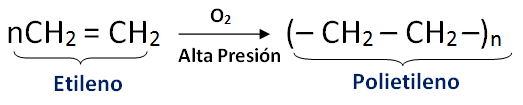
Polimerización
Bajo condiciones apropiadas un alqueno logra reaccionar con otras moléculas similares, formandopolímeros. Un polímero está formado por un conjunto de moléculas iguales, en muchos casos carios cientos de miles; a la unidad molecular básica se le llama monómero.
Hay polímeros naturales (caucho, proteínas, etc..), como también gran variedad de polímeros sintéticos.
El etileno al calentarse con oxígeno a alta presión, genera un polímero de alto peso molecular llamadopolietileno.

Un importante polímero es el “teflón”, muy usado en cocinas y parrillas eléctricas, por sus características de ser un aislante eléctrico y conservar su estabilidad hasta 325°C.

Combustión
Como todos los hidrocarburos, los alquenos son combustibles, ardiendo en presencia de oxígeno.

Ejemplos:
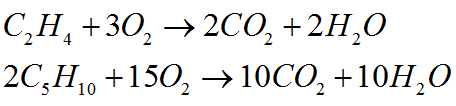
ALQUINOS
Los alquinos son hidrocarburos alifáticos con al menos un triple enlace -C≡C- entre dos átomos de carbono. Se trata de compuestos metaestables debido a la alta energía del triple enlace carbono-carbono. Su fórmula general es CnH2n-2
NOMENCLATURA
Regla 1. Los alquinos responden a la fórmula CnH2n-2 y se nombran sustituyendo el sufijo -ano del alca-no con igual número de carbonos por -ino.
Regla 2. Se elige como cadena principal la de mayor longitud que contiene el triple enlace. La numeración debe otorgar los menores localizadores al triple enlace.
Regla 3. Cuando la molécula tiene más de un triple enlace, se toma como principal la cadena que contiene el mayor número de enlaces triples y se numera desde el extremo más cercano a uno de los enlaces múltiples, terminando el nombre en -diino, triino, etc.
Regla 4. Si el hidrocarburo contiene dobles y triples enlaces, se procede del modo siguiente:
1. Se toma como cadena principal la que contiene al mayor número posible de enlaces múltiples, prescindiendo de si son dobles o triples.
2. Se numera para que los enlaces en conjunto tomen los localizadores más bajos. Si hay un doble enlace y un triple a la misma distancia de los extremos tiene preferencia el doble.
3. Si el compuesto tiene un doble enlace y un triple se termina el nombre en -eno-ino; si tiene dos dobles y un triple, -dieno-ino; con dos triples y un doble la terminación es, -eno-diino
REACCIONES QUÍMICAS
Adición de hidrógeno
Con el empleo de catalizadores como platino, paladio o niquel, los alquinos se adicionan a hidrógenos produciendo un alqueno.
Ejemplo:

Adición de halógenos
El cloro o el bromo se adicionan a un triple enlace, pudiendo obtenerse un dihaloalqueno o un tetrahaloalcano.

Ejemplo:
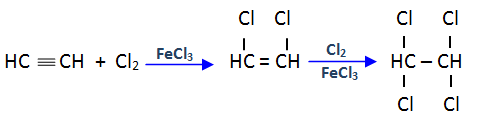
Adición de halogenuros de hidrógeno
El HCl, HBr o HI se pueden adicionar a un triple enlace, produciendo un haloalqueno o un dihaloalcano.

Ejemplo:

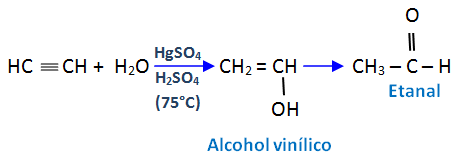
Adición de agua
La adición directa de agua al acetileno, en presencia de sulfato mercúrico y H2SO4 acuoso, es un método industrial para la obtención de etanal.

Polimerización
El acetileno se puede polimerizar dando benceno, esto se logra a 70°C y 15 atm., en presencia de catalizadores especiales.


No hay comentarios:
Publicar un comentario